Determination of Migration of Six Metal Ions in Food Contact Plastic
-
摘要:
本研究利用金属离子可与乙腈、甲酸形成稳定团簇离子的性质,建立了液相色谱-四极杆-飞行时间质谱(LC-QTOF MS)法测定食品接触塑料中Cd2+、Co2+、Cu2+、Mn2+、Ni2+、Zn2+等6种金属离子迁移量。采用Ultimate Hilic amide色谱柱,以0.02%甲酸溶液-乙腈为流动相进行梯度洗脱,在电喷雾离子源正离子(ESI+)模式下,采用多反应监测-高分辨(MRM HR)模式检测。结果表明,本方法的检出限为0.02~0.08 mg/kg,回收率为88.6%~115%,相对标准偏差(RSD)为0.3%~6.1%。采用本方法检测24批次食品接触塑料样品的迁移液,在4批次样品迁移液中检出Cu2+、Mn2+、Zn2+。该方法可直接检测高乙醇比例溶液中金属离子浓度,用于食品接触塑料中钴、铜、锰、锌元素的合规性筛查,对食品接触塑料中未知风险物质的分析有着较好的参考价值。
-
关键词:
- 液相色谱-四极杆-飞行时间质谱(LC-QTOF MS) /
- 金属离子 /
- 食品接触塑料 /
- 迁移量
Abstract:Additives containing metal ions can be added to food contact plastic as stabilizer, catalyzer, colorant, etc. Food safety standards also request specific migration limits (SMLs) for metal elements. The most common methods for determination of multiple metal elements in solutions are inductively coupled plasma-optical emission spectrometry (ICP-OES) and inductively coupled plasma-mass spectrometry (ICP-MS). Metal ions in solution can cluster or coordinate with organic compounds to form new stable complicated ions, which can be detected by electrospray ionization-mass spectrometry (ESI-MS). To apply this nature for determination of metal ions by liquid chromatography-quadrupole time-of-flight mass spectrometry (LC-QTOF MS), further parameter optimization is needed. In this study, five kinds of aqueous mobile phases, including 0.02% (W/W) glycollic acid, 0.02% (V/V) formic acid, 0.10% (V/V) formic acid, 5 mmol/L ammonium formate, and 5 mmol/L ammonium formate-0.02% (V/V) formic acid, were compared for better performance of MS analysis coupled to Ultimate Hilic amide column. Different acids can give rise to form different cluster ions. Higher concentration of formic acid in aqueous mobile phase can produce better peak shape but doesn’t enhance signal to noise ratio apparently. Addition of ammonium ions can weak the signal of cluster ions. With 0.02% formic acid as the mobile phase, Cd2+, Co2+, Mn2+, Ni2+, Zn2+ form [M(HCOO)+CH3CN]+ parent ion, while Cu2+ forms [M+2CH3CN]+ parent ion. The parent ions of Cd2+, Co2+, Mn2+ and Zn2+ are collided to form [M]+, [M(H)]+, [M(H)+CH3CN]+, [M(HCOO)]+, while the parent ion of Ni2+ to form [Ni]+, [Ni(H)]+, [Ni+CH3CN]+, [Ni(H)+CH3CN]+, [Ni+CH3CN+N2]+, [NiO+CH3CN]+, [Ni(OH)+CH3CN]+, the parent ion of Cu2+ to form [Cu]+, [Cu+CH3CN]+, [Ni+CH3CN+N2]+. Finally, the optimized LC-QTOF MS method was applied to determine the migration of Cd2+, Co2+, Cu2+, Mn2+, Ni2+, Zn2+ in food contact plastic. ESI-QTOF MS analysis was performed under positive ion mode (ESI+) and multiple reaction monitor high resolution (MRM HR) mode. The limits of detection (LODs) of 6 metal ions range from 0.02 to 0.08 mg/kg, recoveries are 88.6%-115%, and the relative standard deviations are between 0.3% and 6.1%. Migration solutions from 24 batches of food contact plastic were tested, while 4 of them contain detectable Cu2+, Mn2+ and Zn2+. The proposed method is easily appliable to determine metal ions in high proportion ethanol aqueous solution without needing to remove the ethanol. It is suitable for compliance screening of cobalt, copper, manganese, zinc in migration solution from food contact plastic, and provides a valuable reference for the analysis of unknown hazardous substances from food contact plastic.
-
含钴、铜、锰、镍、锌元素的添加剂允许用于食品接触塑料及制品中,各元素的特定迁移量分别为0.05、5、0.6、0.01、25 mg/kg[1]。Cd是一种重要的有毒重金属,联合国粮农组织和世界卫生组织食品添加剂联合专家委员会(JECFA)提出的Cd元素每月耐受摄入量(PTMI)为25 µg/kg·bw。我国规定了食品接触陶瓷、玻璃制品中Cd元素的迁移限量[2-3]。
目前,常见的金属元素检测方法有比色法、电化学分析法、原子吸收光谱法、原子荧光光谱法、电感耦合等离子体原子发射光谱法、电感耦合等离子体质谱法和X射线荧光光谱法,此外,还包括一些新兴检测方法,如纳米荧光传感器法、免疫检测法、酶传感器法等[4-5]。液相色谱-蒸气发生-原子荧光联用技术、液相色谱(离子色谱)-电感耦合等离子体质谱法也可用于砷、汞、铬等元素的形态分析[6-7]。GB/T 31604−2023[8]规定了多种元素迁移量的测定方法,其中,电感耦合等离子体质谱法的检出限≤0.006 mg/kg,电感耦合等离子体发射光谱法的检出限≤0.03 mg/kg。然而,对于含乙醇的食品模拟物,上述2种方法需先加热去除乙醇(不得蒸干),再用硝酸溶液重新定容后上机测试,前处理费时、效率低。
激光溅射-分子束-反射式飞行时间质谱技术可检测到多种过渡金属(Ni、Ti、V、Cr、Cu、Fe)与有机小分子(甲醇、乙醇、乙腈)形成的团簇离子,其中金属离子均为+1价[9-10]。溶液中的金属离子能够与乙腈、乙酸、硝酸根、8-羟基喹啉、丁二酮肟、水杨酸、双硫腙、二乙基二硫代氨基甲酸、氯离子[11]、乙二胺、N,N-二甲基甲酰胺[12]、肽[13-14]、柠檬酸[15]、蛋白质[16]、辅酶[17]、超分子[18]、脱氧麦根酸和烟草胺[19]等多种分子形成配位化合物,可通过电喷雾质谱(ESI-MS)检测到。
本研究利用金属离子与有机小分子形成的团簇离子可被ESI-MS检测的特性,建立液相色谱-四极杆-飞行时间质谱(LC-QTOF MS)法检测食品接触塑料及制品中6种金属离子迁移量。
1. 实验部分
1.1 仪器与装置
Aquity UPLC H-Class Plus超高效液相色谱仪:美国Waters公司产品;X500B四极杆飞行时间质谱仪:美国SCIEX公司产品,配有电喷雾离子源(ESI)及SCIEX OS集成软件;Milli-Q IQ7000超纯水器:美国Millipore公司产品;Centrifuge 5430R离心机:德国Eppendorf公司产品。
1.2 材料与试剂
Ultimate Hilic amide色谱柱(100 mm×2.1 mm,3 μm):月旭科技公司产品;ChromCore Hilic amide、ChromCore Hilic diol色谱柱(100 mm×2.1 mm,3 μm):纳谱科技公司产品;Cd、Mn(Ⅱ)、Ni标准溶液(1 000 mg/L):美国AccuStandard 公司产品;Co、Cu、Zn标准溶液(1 000 mg/L):国家有色金属及电子材料分析测试中心产品;乙醇、乙腈(色谱纯),甲酸(质谱纯):德国CNW公司产品;乙酸(分析纯):广州化学试剂厂产品;乙醇酸(70%水溶液):上海麦克林生化科技公司产品;甲酸铵(质谱纯):阿拉丁生化科技公司产品;实验用水为超纯水。
24批次食品接触塑料样品:实验室留样。
1.3 溶液配制
混合标准中间液配制:分别移取2.5 mL Cd、Co标准溶液和5 mL Cu、Mn、Ni、Zn标准溶液于50 mL聚丙烯容量瓶中,用水定容至刻度,混匀,于4 ℃保存。其中,Cd2+、Co2+浓度为50 mg/L,Cu2+、Mn2+、Ni2+、Zn2+浓度为100 mg/L。
混合标准工作液1(用于水、10%乙醇、20%乙醇、50%乙醇、4%乙酸食品模拟物)配制:分别移取0、 0.050、0.100、0.200、0.400、0.600、0.800 mL混合标准中间液于50 mL聚丙烯容量瓶中,加入0.5 mL甲酸,用水定容至刻度,混匀,于4 ℃保存。
混合标准工作液2(用于95%乙醇食品模拟物)配制:分别移取0、 0.050、0.100、0.200、0.400、0.600、0.800 mL混合标准中间液于50 mL聚丙烯容量瓶中,加入0.5 mL甲酸,用95%乙醇定容至刻度,混匀,于4 ℃保存。
水、4%乙酸、10%乙醇、20%乙醇、50%乙醇、95%乙醇食品模拟物:按照 GB 5009.156−2016[20]配制。
1.4 样品处理
1.4.1 迁移实验
按照GB 5009.156−2016[20]和GB 31604.1−2015[21]对样品进行迁移实验。对于有标称净含量的金属罐等容器类样品,按标称净含量将相应体积的食品模拟物注入样品中;对于未明确标称净含量的容器类样品,以加入食品模拟物液面与容器类样品上边缘距离不超过1 cm的原则注入食品模拟物;对于涂片等非容器类样品,按常规试样接触面积与食品模拟物体积比S/V(6 dm2接触面积对应1 L或1 kg食品模拟物)将相应体积的食品模拟液注入迁移池中,浸泡样品的食品接触面,按指定的温度和时间进行迁移实验。将完成迁移实验的迁移液转移至试剂瓶中,放置至室温,补齐相应食品模拟物至原体积。将不能立刻进行前处理的迁移液置于4 ℃冰箱中避光保存,进行下一步处理前恢复至室温。
1.4.2 迁移液前处理
取适量迁移液于2 mL离心管中,以10 000 r/min离心5 min,取1.0 mL上清液于聚丙烯液相小瓶中,加入10 µL甲酸,混匀,待测。
1.5 实验条件
1.5.1 色谱条件
Ultimate Hilic amide色谱柱(100 mm×2.1 mm,3 μm);流动相:0.02%甲酸溶液(A)-乙腈(B);流速0.35 mL/min;梯度洗脱程序:0~2.0 min(65%~30%B),2.0~4.0 min(30%B),4.0~5.0 min(30%~65%B),5.0~8.0 min(65%B);柱温为室温;进样量2 μL。
1.5.2 质谱条件
电喷雾离子源正离子(ESI+)模式,多反应监测-高分辨(MRM HR)模式检测,喷雾电压3 000 V,喷雾气压强413 kPa,辅助加热气压强413 kPa,气帘气压强276 kPa,温度600 ℃,碰撞气为7,TOF MS/MS采集时间0.04 s,去簇电压20 V,碰撞能20 V,碰撞能扩展10 V,质谱定量离子对列于表1。
表 1 各离子的监测离子对及对应的化学式Table 1. Ion pairs and possible corresponding chemical formulas序号
No.离子
Ion离子对
Ion pair (m/z)可能的对应离子 Possible corresponding ion 母离子
Parent ion定量离子
Quantitative ion定性离子
Qualitative ion其他子离子
Other ion1 Cd2+ 199.93>158.901*, 155.938 [Cd(HCOO)+CH3CN]+ [Cd(HCOO)]+ [Cd(H)+CH3CN]+ [Cd]+,[Cd(H)]+ 2 Co2+ 144.96>100.968*, 59.941 [Co(HCOO)+CH3CN]+ [Co(H)+CH3CN]+ [Co(H)]+ [Co(HCOO)]+,[Co]+,[Co+CH3CN]+ 3 Cu2+ 144.98>103.956*, 62.930 [Cu+2CH3CN]+ [Cu+CH3CN]+ [Cu]+ [Cu+CH3CN+N2]+ 4 Mn2+ 140.96>96.972*, 99.936 [Mn(HCOO)+CH3CN]+ [Mn(H)+CH3CN]+ [Mn(HCOO)]+ [Mn]+,[Mn(H)]+ 5 Ni2+ 143.96>98.962*, 99.970 [Ni(HCOO)+CH3CN]+ [Ni+CH3CN]+ [Ni(H)+CH3CN]+ [Ni]+,[Ni(H)]+,[Ni+CH3CN+N2]+,
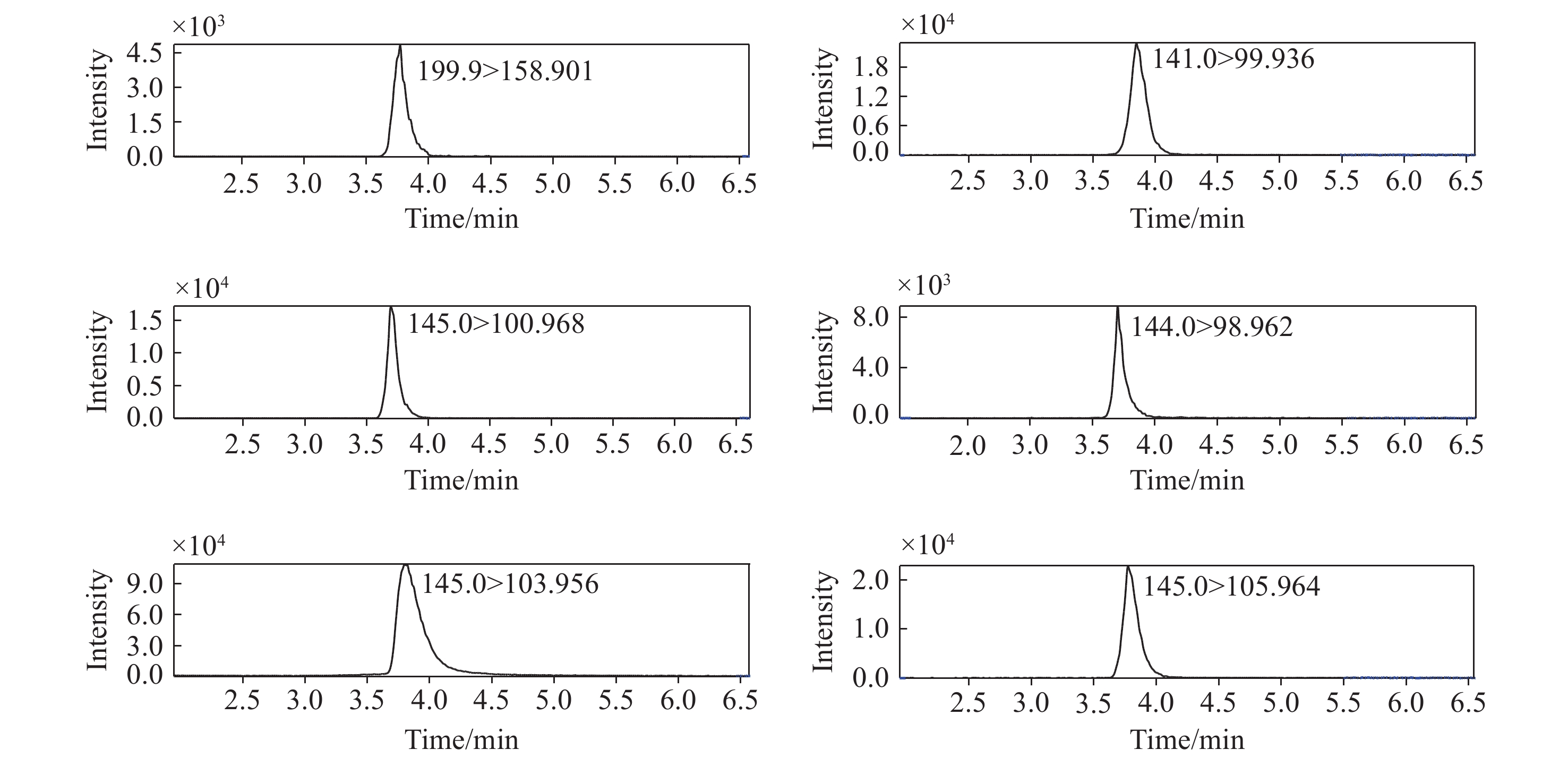
[NiO+CH3CN]+,[Ni(OH)+CH3CN]+6 Zn2+ 149.95>105.964*, 64.937 [Zn(HCOO)+CH3CN]+ [Zn(H)+CH3CN]+ [Zn(H)]+ [Zn]+,[Zn(HCOO)]+ 注:*表示定量离子 2. 结果与讨论
2.1 实验条件优化
2.1.1 流动相和色谱柱的选择
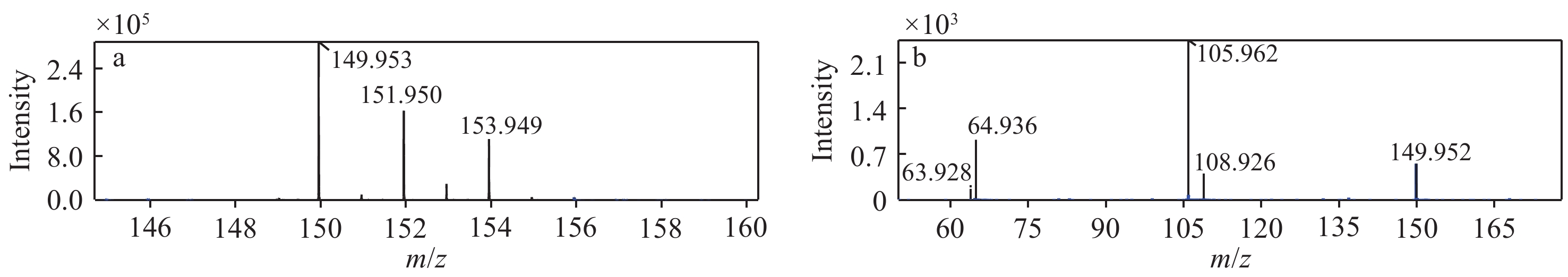
本实验对比了甲酸和乙醇酸2种水相流动相添加物与金属离子形成的团簇离子,以及这些团簇离子在质谱检测的表现。结果表明,除Cu2+离子外,其他金属离子在2种不同添加物下均形成了不同的团簇离子。使用乙醇酸作为添加物时,Cd2+形成[CdCl+CH3CN]+离子,其他4种金属离子形成[M(CH2(OH)COO)+CH3CN]+离子。但乙醇酸作为添加物时,质谱总离子流基线较高,且乙醇酸沸点较高,对仪器损耗更大,故选择甲酸作为水相流动相添加物。其中,Zn2+离子的一级和二级质谱图示于图1。
本实验比较了0.02%甲酸溶液、0.10%甲酸溶液、5 mmol/L甲酸铵溶液、5 mmol/L甲酸铵-0.02%甲酸溶液4种不同的水相流动相对检测效果的影响。结果表明,水相流动相中引入铵离子后,各金属离子所形成的团簇离子响应显著降低。相比于0.02%甲酸,使用0.10%甲酸可使各离子色谱峰形更尖锐,但色谱保留更弱,质谱响应也更弱。因此,选择0.02%甲酸作为水相流动相。
本实验还比较了Ultimate Hilic amide、ChromCore Hilic amide、ChromCore Hilic diol 3款色谱柱的洗脱效果。在相同的流动相下,各金属离子在ChromCore Hilic amide色谱柱无色谱峰,在ChromCore Hilic diol色谱柱色谱峰展宽且响应显著减弱,表明这2款色谱柱与金属离子有较强的相互作用,难以有效洗脱。Ultimate Hilic amide色谱柱对金属离子有较好的保留且峰形尖锐,可以减少溶液中基质对各离子检测的影响,但无法分离各离子。综合考虑,最终采用 Ultimate Hilic amide色谱柱,各定量离子对提取离子色谱图示于图2。
2.1.2 前处理和标准溶液配制溶剂的选择
通过离心对样品进行前处理,并在上机溶液中加入10 µL甲酸,有利于金属离子的稳定。由于水、10%乙醇、20%乙醇、50%乙醇、4%乙酸食品模拟物上机溶液与用1%甲酸配制的标准溶液溶剂效应无明显差别,因此,这些模拟物均采用混合标准工作液1作为定量工作液。95%乙醇食品模拟物上机溶液与1%甲酸配制的标准溶液溶剂效应有明显差别(相同浓度下,Cu2+在95%乙醇食品模拟物上机溶液的响应比在1%甲酸配制的标准溶液的响应下降了约30%),因此,采用混合标准工作液2作为定量工作液。
2.2 实验结果
2.2.1 线性关系和方法检出限
对1.3节配制的标准溶液进行分析,以目标物浓度为横坐标,峰面积为纵坐标绘制工作曲线,各离子的工作曲线和相关系数列于表2。可见,各离子工作曲线的相关系数(r2)均高于0.995,仪器检出限(S/N≥3)在20~80 μg/L之间。仪器定量限(S/N≥10)为工作曲线的最低浓度点,对应的方法定量限为加标实验的最低浓度,结果列于表3。
表 2 各离子的工作曲线及仪器检出限Table 2. Working curves and instrument detection limits of the ions序号
No.离子
Ion保留时间
Retention time/min线性范围
Linear range/
(μg/L)工作曲线
Working curve相关系数
Correlation coefficient
(r2)检出限
LOD/
(μg/L)1 Cd2+ 3.8 50~800
50~800y=46.42x+86.21 0.9996 20 y=42.93x−30.43 0.9975 20 2 Co2+ 3.7 50~800
50~800y=137.3x+1518 0.9992 20 y=130.4x+1449 0.9995 20 3 Cu2+ 3.8 100~1600
200~1600y=959.7x−5164 0.9997 40 y=1782x−2.039×105 0.9984 80 4 Mn2+ 3.8 200~1600
200~1600y=123.5x+2135 0.9992 80 y=120.0x+191.6 0.9959 80 5 Ni2+ 3.7 200~1600
200~1600y=26.70x+3722 0.9969 80 y=27.82x+1.077×105 0.9995 80 6 Zn2+ 3.8 100~1600
100~1600y=118.3x+5222 0.9985 40 y=106.5x+4223 0.9996 40 表 3 各食品模拟物中的加标回收率和相对标准偏差Table 3. Recoveries and relative standard deviations in different food simulants序号
No.加标浓度1)
Spiked level/(mg/kg)方法检出限
LOD/(mg/kg)加标回收率Recovery/% (相对标准偏差RSD/%) 水
Water4%乙酸
4%AcOH10%乙醇
10%EtOH20%乙醇
20%EtOH50%乙醇
50%EtOH95%乙醇
95%EtOH1 0.05 0.02 96.8(5.3) 98.6(4.2) 101.0(1.9) 96.2(3.9) 99.3(2.1) 99.8(3.8) 0.40 101.0(2.6) 95.8(2.1) 100.9(2.4) 100.8(2.9) 102.0(2.2) 99.9(2.7) 0.80 97.8(1.6) 93.0(2.6) 97.4(1.9) 100.8(1.5) 102.0(3.6) 103.0(2.6) 2 0.05 0.02 108.0(4.4) 97.7(2.5) 106.0(2.0) 97.8(3.4) 98.3(2.2) 91.8(1.5) 0.40 99.6(1.7) 88.6(1.2) 98.4(1.6) 102.0(1.8) 102.0(2.7) 99.7(1.8) 0.80 98.1(0.9) 93.2(0.4) 98.6(1.3) 103.0(1.1) 103.0(1.1) 106.0(0.6) 32) 0.10 0.04/0.083) 97.4(2.9) 102.0(4.2) 99.4(1.8) 97.0(2.9) 90.4(3.4) 98.3(2.1) 0.80 95.6(3.8) 99.5(3.7) 98.2(4.0) 101.0(2.1) 96.4(5.3) 100.9(3.9) 1.60 101.0(2.4) 93.9(3.8) 93.3(1.8) 94.8(6.0) 98.5(6.1) 97.3(2.3) 4 0.20 0.08 101.0(3.5) 106.0(1.0) 98.5(2.4) 97.7(1.9) 98.2(2.2) 100.3(2.7) 0.80 105.0(1.7) 107.0(1.3) 105.0(1.5) 99.9(1.4) 102.0(1.8) 96.0(1.9) 1.60 99.0(1.1) 104.0(1.0) 98.7(1.2) 102.0(1.4) 104.0(1.9) 100.1(1.7) 5 0.20 0.08 98.2(2.9) 88.8(5.4) 97.9(3.6) 99.8(1.6) 99.8(1.4) 97.5(3.2) 0.80 104.0(1.5) 104.0(1.7) 104.0(2.2) 103.0(2.0) 102.0(4.7) 92.0(3.0) 1.60 94.1(2.3) 99.5(1.8) 98.9(2.1) 101.0(3.6) 105.0(6.1) 103.0(1.5) 6 0.10 0.04 102.0(1.5) 115.0(3.8) 99.7(4.3) 112.0(3.3) 114(3.6) 99.1(4.8) 0.80 97.9(0.9) 96.2(2.6) 99.1(1.5) 102.0(4.5) 103.0(0.9) 99.5(2.8) 1.60 99.5(0.3) 91.8(0.8) 99.3(1.3) 100.9(1.0) 101.0(0.8) 99.0(0.9) 注:1)食品模拟物密度以1 kg/L计,最低加标浓度为方法定量限;2)水、4%乙酸、10%乙醇、20%乙醇、50%乙醇的加标浓度为0.10、0.80、1.60 mg/kg,95%乙醇的加标浓度为0.20、0.80、1.60 mg/kg;3)水、4%乙酸、10%乙醇、20%乙醇、50%乙醇的方法检出限为0.04 mg/kg,95%乙醇的方法检出限为0.08 mg/kg 2.2.2 准确度和精密度
取食品接触塑料样品,分别使用水、4%乙酸、10%乙醇、20%乙醇、50%乙醇、95%乙醇食品模拟物进行迁移实验,向迁移液中加入低、中、高3个浓度水平的目标物,按1.4.2节处理后测定,每个水平重复6次,计算回收率和相对标准偏差(RSD),结果列于表3。可见,方法的回收率为88.6%~115%,RSD为0.3%~6.1%。
2.3 实际样品检测
本实验测试了24批次食品接触塑料制品的迁移液。在1份聚乙烯(PE)树脂迁移液中检出Zn2+、Cu2+离子,在1份PE垫片迁移液中检出Zn2+、Mn2+离子,在2份PET瓶样品迁移液中检出Mn2+离子。检出量均低于方法定量限,低于现行食品安全国家标准[1]对这些元素的迁移限值。
3. 结论
本研究建立了LC-QTOF MS法测定食品接触塑料中6种金属离子迁移量,并比较了在不同流动相添加物条件下形成的团簇离子,利用金属离子可与乙腈、甲酸形成稳定团簇离子的性质,优化了液相色谱流动相等条件。同时,利用本方法在实际食品接触塑料制品迁移液中检出了Zn2+、Cu2+、Mn2+离子。本方法可直接检测高乙醇比例溶液中的金属离子,用于食品接触塑料中钴、铜、锰、锌元素迁移量的合规性筛查,对于食品接触塑料中未知风险物质的分析有较好的参考价值。
-
表 1 各离子的监测离子对及对应的化学式
Table 1 Ion pairs and possible corresponding chemical formulas
序号
No.离子
Ion离子对
Ion pair (m/z)可能的对应离子 Possible corresponding ion 母离子
Parent ion定量离子
Quantitative ion定性离子
Qualitative ion其他子离子
Other ion1 Cd2+ 199.93>158.901*, 155.938 [Cd(HCOO)+CH3CN]+ [Cd(HCOO)]+ [Cd(H)+CH3CN]+ [Cd]+,[Cd(H)]+ 2 Co2+ 144.96>100.968*, 59.941 [Co(HCOO)+CH3CN]+ [Co(H)+CH3CN]+ [Co(H)]+ [Co(HCOO)]+,[Co]+,[Co+CH3CN]+ 3 Cu2+ 144.98>103.956*, 62.930 [Cu+2CH3CN]+ [Cu+CH3CN]+ [Cu]+ [Cu+CH3CN+N2]+ 4 Mn2+ 140.96>96.972*, 99.936 [Mn(HCOO)+CH3CN]+ [Mn(H)+CH3CN]+ [Mn(HCOO)]+ [Mn]+,[Mn(H)]+ 5 Ni2+ 143.96>98.962*, 99.970 [Ni(HCOO)+CH3CN]+ [Ni+CH3CN]+ [Ni(H)+CH3CN]+ [Ni]+,[Ni(H)]+,[Ni+CH3CN+N2]+,
[NiO+CH3CN]+,[Ni(OH)+CH3CN]+6 Zn2+ 149.95>105.964*, 64.937 [Zn(HCOO)+CH3CN]+ [Zn(H)+CH3CN]+ [Zn(H)]+ [Zn]+,[Zn(HCOO)]+ 注:*表示定量离子 表 2 各离子的工作曲线及仪器检出限
Table 2 Working curves and instrument detection limits of the ions
序号
No.离子
Ion保留时间
Retention time/min线性范围
Linear range/
(μg/L)工作曲线
Working curve相关系数
Correlation coefficient
(r2)检出限
LOD/
(μg/L)1 Cd2+ 3.8 50~800
50~800y=46.42x+86.21 0.9996 20 y=42.93x−30.43 0.9975 20 2 Co2+ 3.7 50~800
50~800y=137.3x+1518 0.9992 20 y=130.4x+1449 0.9995 20 3 Cu2+ 3.8 100~1600
200~1600y=959.7x−5164 0.9997 40 y=1782x−2.039×105 0.9984 80 4 Mn2+ 3.8 200~1600
200~1600y=123.5x+2135 0.9992 80 y=120.0x+191.6 0.9959 80 5 Ni2+ 3.7 200~1600
200~1600y=26.70x+3722 0.9969 80 y=27.82x+1.077×105 0.9995 80 6 Zn2+ 3.8 100~1600
100~1600y=118.3x+5222 0.9985 40 y=106.5x+4223 0.9996 40 表 3 各食品模拟物中的加标回收率和相对标准偏差
Table 3 Recoveries and relative standard deviations in different food simulants
序号
No.加标浓度1)
Spiked level/(mg/kg)方法检出限
LOD/(mg/kg)加标回收率Recovery/% (相对标准偏差RSD/%) 水
Water4%乙酸
4%AcOH10%乙醇
10%EtOH20%乙醇
20%EtOH50%乙醇
50%EtOH95%乙醇
95%EtOH1 0.05 0.02 96.8(5.3) 98.6(4.2) 101.0(1.9) 96.2(3.9) 99.3(2.1) 99.8(3.8) 0.40 101.0(2.6) 95.8(2.1) 100.9(2.4) 100.8(2.9) 102.0(2.2) 99.9(2.7) 0.80 97.8(1.6) 93.0(2.6) 97.4(1.9) 100.8(1.5) 102.0(3.6) 103.0(2.6) 2 0.05 0.02 108.0(4.4) 97.7(2.5) 106.0(2.0) 97.8(3.4) 98.3(2.2) 91.8(1.5) 0.40 99.6(1.7) 88.6(1.2) 98.4(1.6) 102.0(1.8) 102.0(2.7) 99.7(1.8) 0.80 98.1(0.9) 93.2(0.4) 98.6(1.3) 103.0(1.1) 103.0(1.1) 106.0(0.6) 32) 0.10 0.04/0.083) 97.4(2.9) 102.0(4.2) 99.4(1.8) 97.0(2.9) 90.4(3.4) 98.3(2.1) 0.80 95.6(3.8) 99.5(3.7) 98.2(4.0) 101.0(2.1) 96.4(5.3) 100.9(3.9) 1.60 101.0(2.4) 93.9(3.8) 93.3(1.8) 94.8(6.0) 98.5(6.1) 97.3(2.3) 4 0.20 0.08 101.0(3.5) 106.0(1.0) 98.5(2.4) 97.7(1.9) 98.2(2.2) 100.3(2.7) 0.80 105.0(1.7) 107.0(1.3) 105.0(1.5) 99.9(1.4) 102.0(1.8) 96.0(1.9) 1.60 99.0(1.1) 104.0(1.0) 98.7(1.2) 102.0(1.4) 104.0(1.9) 100.1(1.7) 5 0.20 0.08 98.2(2.9) 88.8(5.4) 97.9(3.6) 99.8(1.6) 99.8(1.4) 97.5(3.2) 0.80 104.0(1.5) 104.0(1.7) 104.0(2.2) 103.0(2.0) 102.0(4.7) 92.0(3.0) 1.60 94.1(2.3) 99.5(1.8) 98.9(2.1) 101.0(3.6) 105.0(6.1) 103.0(1.5) 6 0.10 0.04 102.0(1.5) 115.0(3.8) 99.7(4.3) 112.0(3.3) 114(3.6) 99.1(4.8) 0.80 97.9(0.9) 96.2(2.6) 99.1(1.5) 102.0(4.5) 103.0(0.9) 99.5(2.8) 1.60 99.5(0.3) 91.8(0.8) 99.3(1.3) 100.9(1.0) 101.0(0.8) 99.0(0.9) 注:1)食品模拟物密度以1 kg/L计,最低加标浓度为方法定量限;2)水、4%乙酸、10%乙醇、20%乙醇、50%乙醇的加标浓度为0.10、0.80、1.60 mg/kg,95%乙醇的加标浓度为0.20、0.80、1.60 mg/kg;3)水、4%乙酸、10%乙醇、20%乙醇、50%乙醇的方法检出限为0.04 mg/kg,95%乙醇的方法检出限为0.08 mg/kg -
[1] GB 9685−2016 食品安全国家标准 食品接触材料及制品用添加剂使用标准[S]. 北京: 中国标准出版社, 2017. [2] GB 4806.4−2016 食品安全国家标准 陶瓷制品[S]. 北京: 中国标准出版社, 2017. [3] GB 4806.5−2016 食品安全国家标准 玻璃制品[S]. 北京: 中国标准出版社, 2017. [4] 宋逍冲, 庞金玲, 黄晓佳. 食品中重金属检测及样品前处理方法研究进展[J]. 食品安全质量检测学报, 2020, 11(15): 4 958-4 966. SONG Xiaochong, PANG Jinling, HUANG Xiaojia. Research progress on the detection of heavy metals and sample preparation methods in food samples[J]. Journal of Food Safety and Quality, 2020, 11(15): 4 958-4 966(in Chinese).
[5] 杨红本, 杨凡, 胡赠彬, 白祥. 食品中无机元素分析方法研究进展[J]. 食品安全质量检测学报, 2017, 8(10): 3 935-3 943. YANG Hongben, YANG Fan, HU Zengbin, BAI Xiang. Advances in the analysis methods of inorganic elements in foods[J]. Journal of Food Safety & Quality, 2017, 8(10): 3 935-3 943(in Chinese).
[6] 董娜, 罗蓰超, 李伟航, 杨忠宝. 液相色谱-蒸汽发生-原子荧光联用技术测定食品中砷、汞的形态[J]. 江苏调味副食品, 2023(4): 30 -33 .DONG Na, LUO Xichao, LI Weihang, YANG Zhongbao. Determination of As and Hg in food by liquid chromatography-steam occurrence-atomic fluorescence technology[J]. Jiangsu Condiment and Subsidiary Food, 2023(4):
30 -33 (in Chinese).[7] 李俞洁, 陈景周. 食品中铬形态的分析研究进展[J]. 广东化工, 2023, 50(20): 59 -61 . doi: 10.3969/j.issn.1007-1865.2023.20.020LI Yujie, CHEN Jingzhou. Research progress on the analysis of chromium forms in food[J]. Guangdong Chemical Industry, 2023, 50(20):
59 -61 (in Chinese). doi: 10.3969/j.issn.1007-1865.2023.20.020[8] GB 31604.49−2023 食品安全国家标准 食品接触材料及制品 多元素的测定和多元素迁移量的测定[S]. 北京: 中国标准出版社, 2023. [9] 王进, 王娟, 高辉, 张允武, 盛六四. 过渡金属离子与乙腈团簇的反应[J]. 化学学报, 2002, 60(9): 1 591-1 595. WANG Jin, WANG Juan, GAO Hui, ZHANG Yunwu, SHENG Liusi. Reactions of transition metals with acetonitrile clusters[J]. Acta Chimica Sinica, 2002, 60(9): 1 591-1 595(in Chinese).
[10] 罗涛, 谢亚菁, 周浩, 唐晓闩. 过渡金属离子Ni+与甲醇、乙醇团簇反应的质谱研究[J]. 科技视界, 2015(17): 32 -33, 245 . doi: 10.3969/j.issn.2095-2457.2015.17.021LUO Tao, XIE Yajing, ZHOU Hao, TANG Xiaoshuan. Experimental study on the reaction of metal ions Ni+ with methanol and ethanol clusters by mass spectrometry[J]. Science & Technology Vision, 2015(17):
32 -33, 245 (in Chinese). doi: 10.3969/j.issn.2095-2457.2015.17.021[11] ROSS A R, IKONOMOU M G, THOMPSON J A, ORIANS K J. Determination of dissolved metal species by electrospray ionization mass spectrometry[J]. Analytical Chemistry, 1998, 70(11): 2 225-2 235.
[12] TSIERKEZOS N G, SCHRÖDER D, SCHWARZ H. Complexation of nickel(II) by ethylenediamine investigated by means of electrospray ionization mass spectrometry[J]. International Journal of Mass Spectrometry, 2004, 235(1):
33 -42 . doi: 10.1016/j.ijms.2004.03.005[13] BARAŁKIEWICZ D, KÓZKA M, PIECHALAK A, TOMASZEWSKA B, SOBCZAK P. Determination of cadmium and lead species and phytochelatins in pea (Pisum sativum) by HPLC-ICP-MS and HPLC-ESI-MS n[J]. Talanta, 2009, 79(2):
493 -498 . doi: 10.1016/j.talanta.2009.04.026[14] WORTMANN A, ROSSI F, LELAIS G, ZENOBI R. Determination of zinc to beta-peptide binding constants with electrospray ionization mass spectrometry[J]. Journal of Mass Spectrometry, 2005, 40(6):
777 -784 . doi: 10.1002/jms.852[15] BERTOLI A C, CARVALHO R, FREITAS M P, RAMALHO T C, MANCINI D T, OLIVEIRA M C, de VARENNES A, DIAS A. Structural determination of Cu and Fe-citrate complexes: theoretical investigation and analysis by ESI-MS[J]. Journal of Inorganic Biochemistry, 2015, 144:
31 -37 . doi: 10.1016/j.jinorgbio.2014.12.008[16] KITOVA E N, EL-HAWIET A, SCHNIER P D, KLASSEN J S. Reliable determinations of protein-ligand interactions by direct ESI-MS measurements. Are we there yet?[J]. Journal of the American Society for Mass Spectrometry, 2012, 23(3):
431 -441 . doi: 10.1007/s13361-011-0311-9[17] WOJCIESZEK J, RUZIK L. Study of bioaccessibility of cobalt species in berries and seeds by mass spectrometry techniques[J]. Journal of Analytical Science and Technology, 2020, 11(1):
26 . doi: 10.1186/s40543-020-00225-7[18] GEUE N. Modern electrospray ionization mass spectrometry techniques for the characterization of supramolecules and coordination compounds[J]. Analytical Chemistry, 2024, 96(19): 7 332-7 341.
[19] TSEDNEE M, HUANG Y C, CHEN Y R, YEH K C. Identification of metal species by ESI-MS/MS through release of free metals from the corresponding metal-ligand complexes[J]. Scientific Reports, 2016, 6: 26 785.
[20] GB 5009.156−2016 食品安全国家标准 食品接触材料及制品迁移试验预处理方法通则[S]. 北京: 中国标准出版社, 2017. [21] GB 31604.1−2015 食品安全国家标准 食品接触材料及制品迁移试验通则[S]. 北京: 中国标准出版社, 2016.



 下载:
下载: